분자 궤도란 무엇일까요?
분자 궤도는 원자 궤도가 결합하여 형성되는 궤도입니다. 원자들이 서로 가까워지면, 각 원자의 원자 궤도들은 서로 상호작용하여 새로운 궤도, 즉 분자 궤도를 생성합니다. 이 분자 궤도는 분자 내 전자의 위치와 에너지를 기술합니다. 단순히 원자 궤도의 합이 아니라, 상호작용을 통해 결합성 궤도와 반결합성 궤도로 나뉘며, 전자는 이들 궤도에 채워집니다. 결합성 궤도는 에너지가 낮고, 원자핵 사이의 전자 밀도가 높아 결합을 강화시키는 역할을 합니다. 반대로 반결합성 궤도는 에너지가 높고, 원자핵 사이의 전자 밀도가 낮아 결합을 약화시킵니다.
분자 궤도 이론은 어떻게 결합을 설명할까요?
분자 궤도 이론은 원자 궤도의 선형결합 (Linear Combination of Atomic Orbitals, LCAO)을 통해 분자 궤도를 설명합니다. 두 개의 원자 궤도가 상호작용하면, 에너지가 낮은 결합성 궤도와 에너지가 높은 반결합성 궤도 두 개의 분자 궤도가 생성됩니다. 전자들은 이 두 궤도에 파울리 배타 원리를 따라 채워집니다. 결합성 궤도에 채워진 전자 수가 반결합성 궤도에 채워진 전자 수보다 많으면, 분자는 안정적인 결합을 형성합니다. 결합 차수는 (결합성 전자 수 – 반결합성 전자 수) / 2 로 계산되며, 결합의 강도를 나타냅니다.
다양한 분자의 분자 궤도: H₂와 O₂ 비교 분석

| 분자 | 원자 궤도 | 분자 궤도 | 결합 차수 | 결합 강도 |
|---|---|---|---|---|
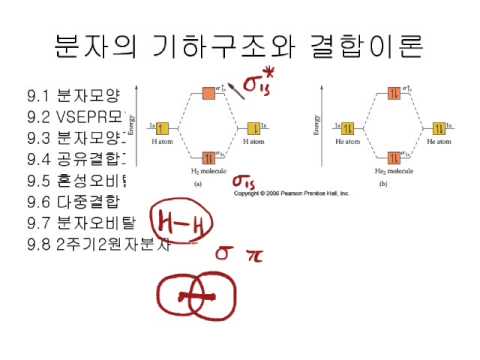
| H₂ | 1s | σ₁s (결합성), σ₁s* (반결합성) | 1 | 강함 |
| O₂ | 2s, 2p | σ₂s, σ₂s, σ₂p, π₂p, π₂p, σ₂p* | 2 | 중간 |
H₂의 경우, 두 개의 1s 원자 궤도가 결합하여 하나의 결합성 σ₁s 궤도와 하나의 반결합성 σ₁s* 궤도를 형성합니다. 두 개의 전자는 결합성 궤도에 채워져 결합 차수 1을 갖게 됩니다. O₂의 경우는 더 복잡하며, 2s와 2p 궤도들이 상호작용하여 여러 개의 분자 궤도를 형성합니다. 결합 차수 2를 가지며 H₂보다 결합 강도가 약합니다. 이처럼 분자 궤도 이론은 다양한 분자의 결합 특성을 설명하는 데 유용합니다.
분자 궤도 이론의 한계는 무엇일까요?

분자 궤도 이론은 간단한 이원자 분자에 대해서는 잘 작동하지만, 복잡한 다원자 분자에 적용할 때는 계산의 복잡성이 증가하고, 근사법을 사용해야 하는 경우가 많습니다. 또한 전자 상호작용을 완벽하게 고려하지 못하는 경우도 있습니다. 따라서 더욱 정확한 계산을 위해서는 밀도범함수이론(DFT)등과 같은 후속 이론이 필요합니다.
함께 보면 좋은 정보: 원자 궤도
원자 궤도는 원자 내 전자의 위치를 기술하는 수학적 함수입니다. 주양자수(n), 방위양자수(l), 자기양자수(ml), 스핀양자수(ms) 네 가지 양자수로 정의되며, 각 양자수는 원자 궤도의 에너지, 모양, 공간적 방향, 스핀을 나타냅니다. s 궤도는 구형이며, p 궤도는 아령 모양이며, d 궤도는 더욱 복잡한 모양을 가지고 있습니다. 원자 궤도의 개념은 분자 궤도 이론의 기본이 됩니다. 원자 궤도의 이해는 분자 궤도를 이해하는데 필수적입니다. 원자 궤도의 모양과 에너지 레벨을 이해하면, 분자 궤도 형성 과정을 더욱 잘 이해할 수 있습니다.
함께 보면 좋은 정보: 결합 차수
결합 차수는 분자 내 두 원자 사이의 결합 강도를 나타내는 지표입니다. 분자 궤도 이론에서, 결합 차수는 (결합성 궤도에 있는 전자 수 – 반결합성 궤도에 있는 전자 수) / 2 로 정의됩니다. 결합 차수가 높을수록 결합이 더 강하고, 결합 길이가 더 짧습니다. 예를 들어, 이중 결합은 단일 결합보다 결합 차수가 높고, 따라서 더 강하고 짧은 결합을 가지고 있습니다. 결합 차수의 개념은 분자의 안정성과 반응성을 이해하는 데 중요한 역할을 합니다.

분자 궤도 이론 심화: 혼성 궤도와 분자 기하

혼성 궤도란 무엇일까요?
혼성 궤도는 서로 다른 종류의 원자 궤도가 섞여서 새로운 궤도를 형성하는 것을 말합니다. 예를 들어, 탄소 원자의 경우, 2s 궤도와 세 개의 2p 궤도가 혼성화되어 네 개의 sp³ 혼성 궤도를 형성할 수 있습니다. 이러한 혼성 궤도들은 메탄(CH₄)과 같이 사면체 구조를 갖는 분자에서 관찰됩니다. sp² 혼성 궤도와 sp 혼성 궤도도 존재하며, 각각 삼각평면형 및 선형 구조를 형성하는 분자에서 나타납니다. 혼성 궤도 개념은 분자의 기하학적 구조를 예측하는데 중요합니다.
분자의 기하 구조와 혼성 궤도의 관계는 무엇일까요?
분자의 기하 구조는 중심 원자의 혼성 궤도의 종류에 따라 결정됩니다. sp³ 혼성 궤도는 사면체 구조, sp² 혼성 궤도는 삼각평면 구조, sp 혼성 궤도는 선형 구조를 형성합니다. 다양한 혼성 궤도는 원자의 결합각과 분자의 전체적인 형태를 설명하는 데 필수적입니다. 이러한 관계를 이해하면 분자의 성질을 예측하는 데 도움이 됩니다.
혼성 궤도와 분자 궤도의 차이점은 무엇인가요?
혼성 궤도는 같은 원자 내의 원자 궤도들의 조합으로 만들어진 궤도인 반면, 분자 궤도는 여러 원자의 원자 궤도들의 결합으로 형성됩니다. 혼성 궤도는 주로 분자의 기하구조를 설명하는 데 사용되며, 분자 궤도는 분자 내 전자의 에너지와 위치를 설명하는 데 사용됩니다. 두 개념은 서로 밀접하게 연관되어 있으며, 분자의 특성을 완전히 이해하기 위해서는 두 개념 모두를 이해해야 합니다.
분자 궤도 이론을 이용한 분자의 성질 예측
분자 궤도 이론을 통해 분자의 전자 배열, 결합 에너지, 결합 길이, 자기적 성질 등 다양한 성질을 예측할 수 있습니다. 예를 들어, 산소 분자(O₂)의 경우, 분자 궤도 이론은 그 자기적 성질이 상자성임을 예측하며, 이는 실험 결과와 일치합니다. 이처럼 분자 궤도 이론은 분자의 성질을 미시적인 관점에서 이해하고 예측하는 강력한 도구입니다.
함께 보면 좋은 정보: VSEPR 이론
VSEPR (Valence Shell Electron Pair Repulsion) 이론은 분자의 기하 구조를 예측하는 데 사용되는 이론입니다. 이 이론은 원자가 전자 쌍 사이의 반발력이 최소화되도록 분자의 기하 구조가 결정된다는 원리에 기반합니다. VSEPR 이론은 간단하고 직관적인 방법으로 분자의 기하 구조를 예측할 수 있지만, 혼성 궤도 이론처럼 분자 내 전자의 에너지와 위치에 대한 정보는 제공하지 않습니다. 두 이론을 함께 이해하면 분자의 구조와 성질에 대한 더욱 포괄적인 이해를 얻을 수 있습니다.
함께 보면 좋은 정보: 분자의 자기적 성질
분자의 자기적 성질은 분자 내 전자의 스핀 상태에 따라 결정됩니다. 모든 전자의 스핀이 짝을 이루면, 분자는 반자성을 띠며, 짝을 이루지 않은 전자가 있으면 상자성을 띱니다. 분자 궤도 이론은 분자 내 전자의 배열을 예측함으로써 분자의 자기적 성질을 예측하는 데 사용될 수 있습니다. 분자의 자기적 성질은 NMR (Nuclear Magnetic Resonance) 분광법과 같은 실험 기법으로 측정될 수 있습니다.